
※本篇為競爭力企管顧問整理資料,若有資料錯誤或不足歡迎與我們聯繫!
前言
2020年因疫情影響,許多廠商也嗅到新的商機,因應口罩供應政府於年初實施口罩管制到開放,也讓我們發現原來醫療用口罩如此重要!而不僅醫療口罩,與醫護相關之醫療器材也受到重視。
在近幾個月中,競爭力收到許多廠商詢問有關於製作口罩設立方法及ISO 13485的問題,所以我們並迅速地整理出簡單的重點,讓大家對於此類問題能夠更加了解!
以下整理重點依流程為主,相關準備文件請廠商依所在地主管機關規定準備!
前置流程(上市前)
一、製造業想要製造醫療器材必須要先取得製造業藥商許可執照方可進行製造:
- 首先公司行業先至 《經濟部商業司》申請公司設立或變更登記,再至公司行業所在地之《衛生局》申請籌設醫療器材特許許可。(相關資訊:請依所在地衛生局查詢)
- 向公司行業所在地之《經濟發展局》申請工廠設立或變更設立,取得「工廠登記證」。
- 向所在地之《衛生局》申請醫療器材製造業 / 販賣業藥商許可執照。所需文件資料如下(依各縣市單位可能會不同,請洽詢當地衛生局較為詳細):
- 販賣(製造)藥商許可執照聲請書
- 藥局、藥商營業場所暨設備略圖
– 藥物販賣業者,其需營業地址、場所(儲存藥品倉庫)級主要設備之平面略圖
– 藥物製造業者,其需工廠登記證及其影本
- 藥商為公司組織者,其公司執照、組織章程影本
- 負責人身份影本
- 聘用藥物管理、監製或技術人員者,其所聘人員之執業執照或證明文件
二、進行GMP醫療器材優良製造規範查廠(相關資訊:國內醫療器材製造廠申請)
- 「醫療器材優良製造規範GMP」
– 國際管理趨勢。
– 參考美國FDA規範及國際認可ISO 13485標準制定而成
– 攸關醫療器材製造品質,確保製程品管的具體措施
- 製造廠需提供「全套」品質保證系統
– 包括醫療器材之品質、產品標示、上市後客戶之抱怨…等。
- 通過認可登陸後為製造品質提供重要評估標準
– 不只上市前申請規格需符合要求,上市後亦需維持產品品質。
三、辦理醫療器材許可證
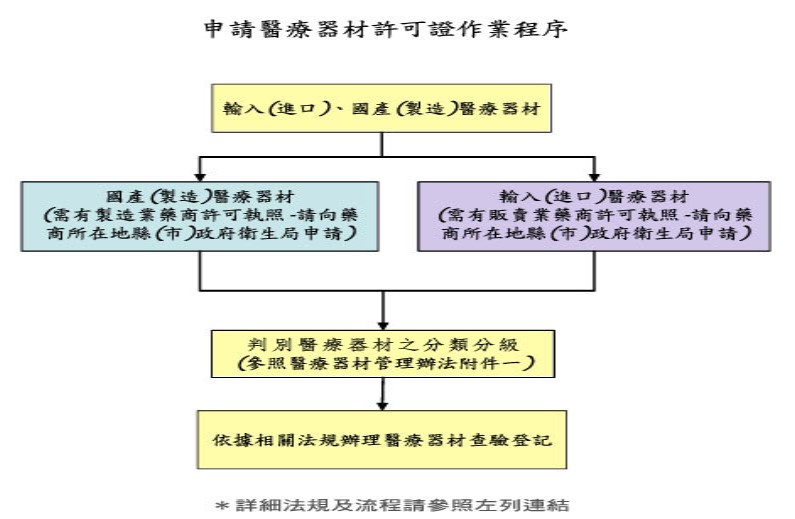
(圖片來源 / 詳細法規流程及方法:衛生福利部食品藥物管理署)
四、醫療器材管理表格
| 製造 | 輸入 | 販賣 | |
| 須具備之執照 |
|
販賣業許可執照 | 製造業或販賣業藥商許可執照 |
| 製造廠品質系統 | *國內製造廠GMP查核 | *國外製造廠QSD審查 | |
| 產品上市前查驗登記 | 醫療器材許可證 | ||
| 上市後管理 | 醫療器材安全監視
不良品及不良反應之通報及預警系統 回收作業 衛生局稽查 市售品抽驗 許可證展延及變更之審核 |
||
五、總結
在第二點中提及GMP,也發現它是參考ISO 13485國際標準制定。這時候就會有疑問出現啦!
–
Q:GMP等於ISO 13485嗎?
A:其實兩者的關係很簡單,GMP是我國所制定的醫療器材優良製造規範,而它是參考於FDA及ISO13485而制定的,所以它們一定會有重複性,而GMP是醫療器材管中必
須的一環,當然ISO 13485也能成為他最佳的輔助工具!
–
Q:一定要通過ISO 13485嗎?
A:通常我們都會建議客人,在品質管理上雖然有了GMP許可,但是再多一個品質管理工具一定可以為後續的管理上更加分!而ISO 13485是國際認可的標準,在未來外銷上,也會是最好的品質證明!
–
Q:我想要製造口罩且已有CNS認證還需要ISO 13485嗎?
A:CNS是國家標準,表示有通過國家認證,但是,它是針對產品本身進行檢驗認證,而ISO 13485是針對品質管理流程,所以不要搞混喔!當然品質管理造就一個產品的品質,也能算是相輔相成的關係喔!
–
Q:公司要製造口罩要從頭開始但是流程好複雜,我該要從何做起?
A:依製造業來說:

參考資料:
行政院衛生署食品藥物管理局-醫療器材化妝品組
經濟部-標準檢驗局
https://mdcons2012.pixnet.net/blog/post/26170009
ISO 13485:2016 輔導諮詢
競爭力企業管理顧問有限公司
全台免付費專線:0800 800 248
或是加入官方LINE:@why4800g
以上皆有專人諮詢服務喔!
Views: 8704
